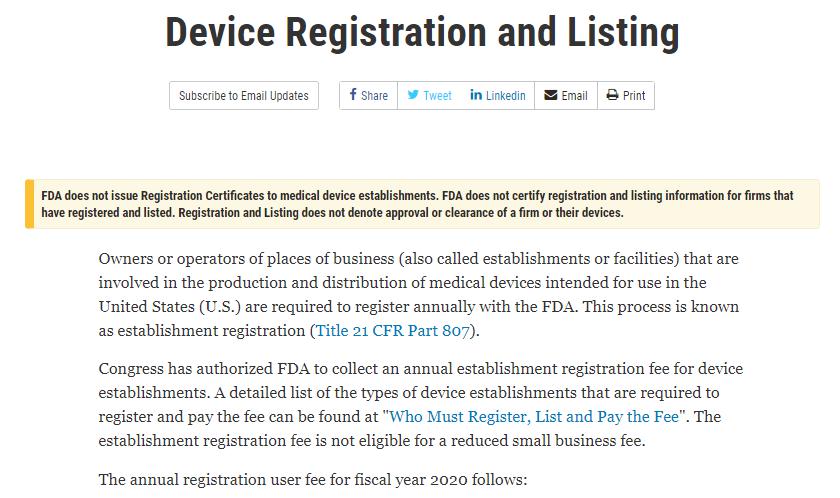
FDAは6月23日、公式ウェブサイト上で「機器の登録とリスト」と題した通知を発行し、次のように強調した。
FDA は医療機器施設に登録証明書を発行しません。FDAは登録と上場を証明していない
登録・上場している企業の情報です。登録と上場は企業の承認または認可を意味するものではありません
またはそのデバイス。
FDA登録において注意すべき点は以下のとおりです。
質問 1: FDA 証明書を発行した機関はどこですか?
A: FDA 登録のための証明書はありません。製品が FDA に登録されている場合は、登録番号を取得します。FDA は申請者に返信書(FDA の最高責任者が署名)を渡しますが、FDA 証明書はありません。
このタイミングでの FDA のこのような通知の発表は、強く思い出させるものです。最近の米国の感染症状況の進展により、米国に輸出される医療防疫製品の需要が大幅に増加しており、輸出登録の需要も増加しています。
一部の企業が FDA になりすましてメーカーに証明書を発行すると、一部の流通企業がメーカーに相談すると偽の「FDA 証明書」を入手する可能性があります。
質問 2: FDA には認定研究所が必要ですか?
A: FDA は法執行機関であり、サービス機関ではありません。FDA には公共サービスがないため、誰かが自分たちが FDA 認証機関であると言う場合、少なくとも消費者に誤解を招くことになります。
性証明機関や検査所には、いわゆる「指定検査所」はありません。連邦法執行機関として、FDAは審判と競技者の両方を兼ねるようなことに携わるべきではない。FDAはサービスのテストのみを行う
検査機関のGMP品質が認められ、認定された検査機関には証明書が発行されますが、一般に「指定」されたり、推奨されるものではありません。
質問 3: FDA の登録には米国の代理店が必要ですか?
A: はい、企業は FDA に登録する際に米国国民 (企業/団体) を代理人として任命する必要があります。代理人は米国内の手続きサービスを担当し、FDA と申請者に連絡する媒体となります。
FDA登録におけるよくある間違い
1. FDA 登録は CE 認証とは異なります。その認証モードは、CE 認証製品のテスト + レポート証明書モードとは異なります。FDA 登録は実際には完全性宣言モードを採用しています。つまり、自社の製品に対して誠実な宣言モードを採用しています。
関連する規格および安全要件に従い、米国連邦ウェブサイトに登録されている製品に事故が発生した場合、製品は相応の責任を負わなければなりません。したがって、ほとんどの製品はFDA登録されており、サンプルの送付テストはありません。
そして証明書の明細書。
2. FDA 登録の有効期間: FDA 登録は 1 年間有効です。1年を超える場合は再登録が必要となり、それに伴う年会費も再度支払う必要があります。
3. FDA には証明書が登録されていますか?
実際には、FDA 登録のための証明書はありません。製品が FDA に登録されている場合は、登録番号を取得します。FDA は申請者に返信書(FDA の最高責任者が署名)を渡しますが、FDA 証明書はありません。
私たちが普段目にする証明書は、FDAが要求する「生産施設登録と製品型式登録」をメーカーが完了するのに役立ったことを証明するために、仲介機関(登録代理人)がメーカーに発行するものです。
(施設登録および機器リスト)、完成したマークは、製造業者が FDA 登録番号を取得するのに役立ちます。
FDAは、さまざまなリスクレベルに応じて医療機器を3つのカテゴリー(I、II、III)に分類しており、クラスIIIは最も高いリスクレベルです。
FDA は、各医療機器の製品分類と管理要件を明確に定義しています。現在、医療機器のカタログは1700種類以上あります。医療機器が米国市場に参入したい場合は、まずマーケティングに申請される製品の分類と管理要件を明確にする必要があります。
上記の情報を明確にした後、企業は関連する申請書類の作成を開始し、一定の手順に従ってFDAに報告して承認を得ることができます。どのような製品であっても、企業は製品を登録してリストする必要があります。
クラスI製品(約47%を占める)については、一般管理を実施しています。大多数の製品は、GMP 基準に登録、リストされ、実装されるだけで済み、米国市場に参入できます (GMP に関連付けられている製品はほとんどありません)。
非常に少数の予約製品は、FDA に 510 (k) 申請書、つまり PMN (市販前通知) を提出する必要があります。
クラスⅡ品(約46%)については特別管理を実施しております。登録および上場後、企業は GMP を実施し、510 (k) 申請を提出する必要があります (510 (k) を免除される製品はほとんどありません)。
クラス III 製品 (約 7%) については、販売前ライセンスが実施されます。登録および上場後、企業はGMPを実施し、FDAにPMA(市販前申請)申請書を提出する必要があります(パートIII)
PMN)。
クラス I 製品の場合、企業が関連情報を FDA に提出した後、FDA は発表のみを行い、関連する証明書は企業に発行されません。クラス II および III のデバイスの場合、企業は PMN または PMA を提出する必要があり、FDA は
企業に正式な市場アクセス承認書を与える。つまり、企業が自社の名前で米国の医療機器市場で自社製品を直接販売できるようにする。
申請プロセスにおいて企業にGMP評価を依頼するかどうかは、製品のリスクレベル、管理要件、市場からのフィードバックなどの総合的な要素に応じてFDAが決定します。
上記のことから、ほとんどの製品は、医療機器の登録、製品リストおよび GMP の実施、または 510 (k) 申請の提出後に FDA 認証を取得できることがわかります。
製品が FDA にリストされているか、510k に登録されているかを確認するにはどうすればよいですか?
唯一の信頼できる方法: FDA の Web サイトで確認する
投稿時間: 2021 年 1 月 9 日